2024年4月30日,本学科刘建中教授课题组在Plant Communications上发表题为“Clathrin Light Chains negatively regulate plant immunity by hijacking the autophagy pathway”的研究论文。

自噬是真核生物在进化上高度保守的分解代谢过程,可清除在胁迫条件下氧化受损的蛋白以及细胞器,如叶绿体、线粒体以及过氧化物酶体等。精准控制自噬是实现在各种胁迫条件下细胞内物质稳态平衡的基础。自噬途径的缺陷会导致氧化受损的细胞器无法被清除,产生大量的ROS,而ROS可诱导水杨酸的合成,从而形成放大免疫信号的ROS-SA正向反馈环,最终导致免疫激活乃至细胞死亡。
网格蛋白介导的内吞(Clathrin-mediated endocytosis, CME)是将质膜蛋白、脂质和胞外分子等向细胞内运输的主要途径,在植物激素信号的调控、生长发育以及抗病性等多种生物学过程中发挥着关键作用。目前,植物中网格蛋白或CME与自噬途径之间是否存在关联以及相互关联的分子机制还待阐明。本研究发现拟南芥网格蛋白轻链Clathrin light chain 2 (CLC2)和CLC3的功能丧失导致叶片出现依赖于SA和H2O2的细胞死亡与免疫激活表型,这与拟南芥自噬相关突变体所表现出的特征高度相似。通过多种手段证明CME和自噬途径之间的关联是通过CLC2与ATG8h/ATG8i的直接互作而介导的,而该互作关系依赖于CLC2氨基酸序列中保守的AIM基序(ATG8-interacting motif)以及ATG8h/ATG8i氨基酸序列中保守的LDS位点(LIR/AIM docking site)。此外,CLC2与ATG8h/ATG8i均可通过自噬途径降解,暗示ATG8h/ATG8i介导CLC2乃至Clathrin-coated vesicle (CCV)的自噬降解。最后,通过CRISPR/CAS9基因编辑技术同时敲除ATG8h和ATG8i后导致拟南芥Golovinomyces cichoracearum抗性的增强,说明CLC2-ATG8h/8i互作在功能上的关联。
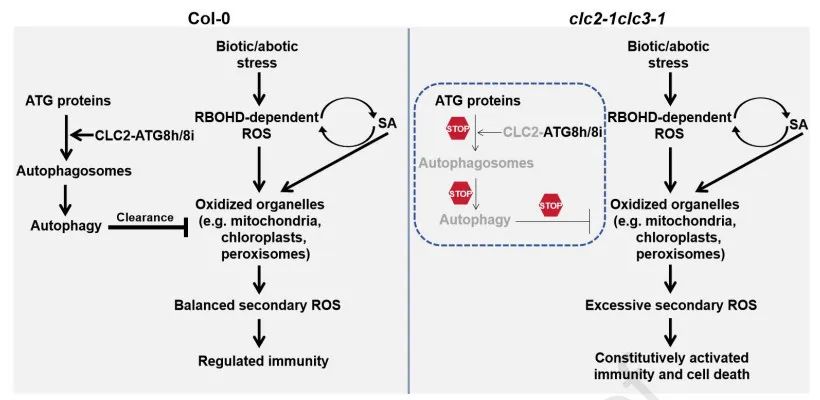
该研究通过遗传、生化与细胞生物学等多种手段揭示了clc2-1 clc3-1突变体出现细胞死亡以及免疫激活表型的分子机理,即CLC2和CLC3功能丧失导致自噬途径受损而激活免疫反应。此项研究建立了CME与自噬这两个此前被认为是相互独立的细胞内运途径之间的关联,因而具一定的新颖性与理论价值。

